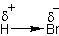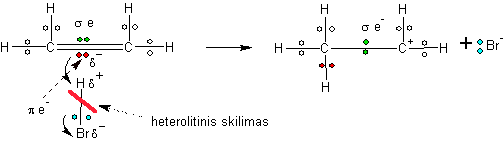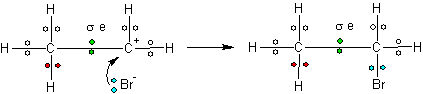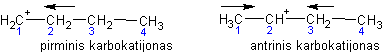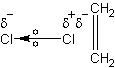Elektrofilinio pakeitimo reakcijos alkenuose
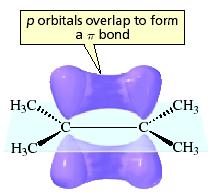
Dvigubąjį ryšį sudaro keturi elektronai. DU iš jų sudaro paprastąjį kovalentinį σ ryšį tarp anglies atomų. Kiti du elektronai yra virš anglies atomų ir po jais riestainio pavidalo erdvėje.
Taigi elektronų „koncentracija“ aplink dvigubąjį ryšį yra smarkiai padidėjusi. Sakoma, kad joje yra padidėjęs elektroninis tankis. Ši alkeno vieta yra šiek tiek neigiamesnė nei likusi molekulės dalis. Alkenus atakuoja dalelės, kurių elektroninis tankis yra sumažėjęs. Šiose jų vietose yra dalinis teigiamas krūvis, kuris trauks neigiamą, todėl tokios dalelės vadinamos elektrofilais. Pvz. vandenilio halogenido molekulė. Kadangi bromo elektrinis neigiamumas yra žymiai didesnis nei vandenilio, bromas pasitraukia elektronus link savęs.
HBr esantis vandenilio atomas su daliniu teigiamu krūviu atakuoja padidinto neigiamo krūvio dvigubą ryšį. Jo π elektronų porą prisitraukia vandenilis, o bromas nuo jo atsiskelia heterolitiškai t.y. pasiimdamas buvusią bendrą jų porą. Susidaro karbokatijonas ir bromo neigiamas jonas.
2 pakopoje labai aktyvų karbokatijoną tuoj pat atakuoja jonas. Susidaro sotus junginys.
Markovnikovo taisyklė
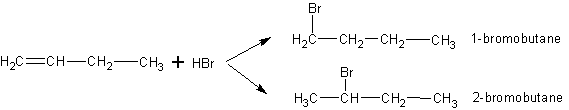
Kaip žinoti, prie kurio anglies atomo prisijungs vandenilio atomas, o prie kurio bromo, jei junginys yra ilgas? Pavyzdžiui žemiau esančiu atveju gali susidaryti du junginiai:
Žinoma, jog susidarys žymiai daugiau 2-brombutano nei 1-brombutano. Kodėl taip yra? Pagal aukščiau nagrinėtą mechanizmą gali susidaryti tokie karbokatijonai:
Susidarius antrajam karbokatijonui, anglies teigiamas krūvis gali būti kompensuojamas iš dviejose pusėse esančių alkilo grupių. Tuo tarpu pirmu atveju yra tik viena alkilo grupė, galinti kompensuoti krūvį. Dėl šios priežasties antrasis karbokatijonas yra stabilesnis, taigi susidarys žymiai daugiau 2-brombutano.
Markovnikovo taisyklė: jungiantis HX molekulei prie alkeno, H atomas jungsis prie labiausiai hidrinto anglies atomo.
Halogeninimas
Alkenų halogeninimas - taip pat elektrofilinio pakeitimo reakcija. Elektrofilas susidaro halogeno molekulei priartėjus prie dvigubojo ryšio. Dėl padidinto elektroninio tankio dvigubo ryšio vietoje indukuojamas dipolis - tas halogeno atomas, kuris yra arčiau ryšio tampa teigiamesnis, nes elektronus nuo jo stumia dvigubojo ryšio elektronų laukas. Taigi susidaro elektrofilas:
Toliau viskas vyksta analogiškai pagal aprašytą mechanizmą.